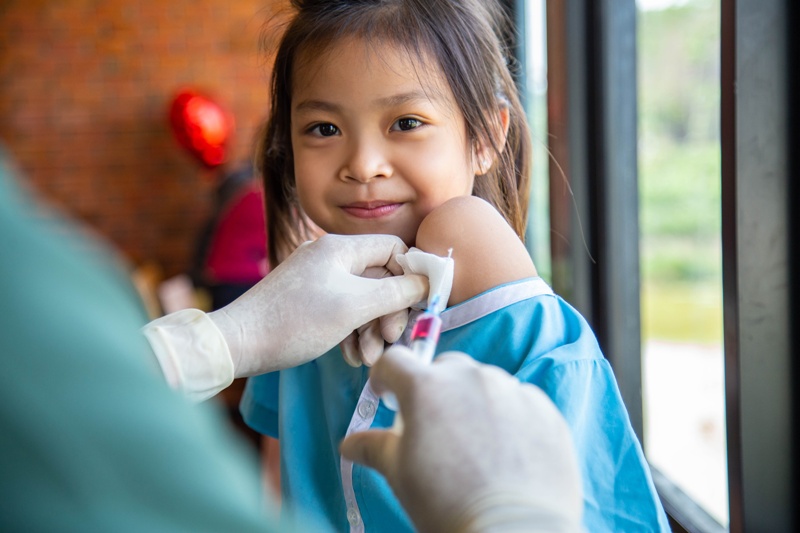
Dopo la Cina, anche gli Stati Uniti potrebbero arrivare a una nuova svolta nella storia della vaccinazione contro il Covid-19.
La Food and Drug Administration, l’agenzia del farmaco americana, si riunirà infatti oggi (26 ottobre ndr) per decidere se dare il proprio via libera alle somministrazioni del siero di Pfizer anche ai 28 milioni di bambini Usa tra i 5 e gli 11 anni.
In caso di raccomandazione positiva per l’approvazione, per passare all’avvio delle concrete inoculazioni seguirà la valutazione dei Centers for Disease Control and Prevention, chiamati a decidere le linee guida e le modalità di somministrazione.
L’iter americano per i vaccini ai bambini
La previsione espressa dall’immunologo Anthony Fauci, consigliere medico del presidente degli Stati Uniti, è che questa nuova fase della campagna vaccinale, rivolta ai bambini delle scuole elementari, potrebbe prendere il via già dalla prima metà di novembre.
“Se tutto va bene – ha dichiarato Fauci – è possibile, se non molto probabile, che i vaccini siano disponibili per questo gruppo di età nella prima o nella seconda settimana di novembre. I dati sembrano buoni sia per efficacia che per sicurezza” è stato il suo commento ai risultati del test presentati da Pfizer-BioNTech.
Sul tavolo degli esperti della Fda c’è proprio la richiesta di autorizzazione alla somministrazione pediatrica del suo vaccino, accompagnata da una serie di raccomandazioni, presentata dalla big pharma americana. E proprio l’Fda, nei giorni scorsi, ha anticipato che, anche nella fascia d’età tra 5 e 11 anni, i benefici per prevenire ospedalizzazione e morte sembrano superare gli eventuali rischi di effetti collaterali derivanti dalla vaccinazione.
Lo studio di Pfizer: efficacia al 90,7% per i più giovani
Il rapporto della Pfizer sui risultati dei test clinici effettuati riporta un tasso di efficacia del 90,7% nel prevenire la malattia sintomatica per i bambini sotto i 12 anni, con un’elevata sicurezza e solo lievi effetti collaterali.
La dose di vaccino inoculata ai 2.268 che hanno partecipato allo studio è stata pari a un terzo (10 microgrammi contro 30) rispetto a quella normalmente somministrata alle persone di età superiore. Pur avendo ricevuto un placebo solo un terzo del campione, in questo secondo gruppo si sono ammalati di Covid 16 bambini contro i 3 risultati positivi tra coloro che hanno ricevuto il principio attivo.
“Penso che il vaccino per i bambini – ha aggiunto Fauci – potrebbe essere un buon passo in avanti. Perché è vero che i bimbi vengono contagiati meno spesso degli adulti dal Sars-Cov2, ma ci sono molti casi in cui i piccoli si ammalano seriamente“.
“Non ci sono timori per il vaccino ai bambini tra 5 e 12 anni” ha intanto affermato il coordinatore del Comitato tecnico scientifico italiano, Franco Locatelli.
In Italia, una decisione in tal senso appare ancora tutta da valutare ma sul vaccino ai bambini si è espresso oggi durante un’intervista a Radio Capital anche il sottosegretario alla Salute Pierpaolo Sileri.
“Il suo arrivo dipenderà dagli enti regolatori e, appena approvato, sarà disponibile in Italia – ha detto -. Ho un figlio di 2 anni e se ci fosse un vaccino disponibile per la sua età lo farei subito”.
I risultati di Moderna sui bambini
Anche l’altra casa farmaceutica produttrice di un vaccino anti-Covid a Rna messaggero, Moderna, ha presentato i primi dati di uno studio di fase 2-3 sui bambini tra 6 e 11 anni. I risultati dichiarati sono “una robusta risposta immunitaria” e un “profilo di sicurezza favorevole”, con effetti indesiderati “di gravità lieve o moderata“. Ovvero, nella maggior parte dei casi, affaticamento, cefalea, febbre e dolore al sito di iniezione.
I test, che hanno coinvolto 4.753 bambini sani , hanno previsto la somministrazione di 2 dosi da 50 microgrammi del vaccino a distanza di 28 giorni. Queste, “generalmente ben tollerate, hanno mostrato titoli di anticorpi neutralizzanti robusti”. Il monitoraggio proseguirà ora per 12 mesi, per valutare la protezione e la sicurezza a lungo termine.
Intanto, anche Moderna presenterà a breve i risultati all’Fda, all’agenzia del farmaco europea Ema (che ha già ricevuto lo studio di Pfizer) e ad altre agenzie regolatorie nel mondo per ottenere le relative autorizzazioni.
Alberto Minazzi