Anche in Italia, nelle settimane successive a Natale, potrebbero essere disponibili le pillole per curare il Covid. L’annuncio arriva dal direttore generale dell’Aifa, Nicola Magrini: “Ci siamo attivati affinchè la prenotazione di questi due farmaci orali, che hanno dato risultati promettenti e confortanti, ci sia il prima possibile, avendo proceduto in accordi in tal senso in questi giorni”, ha spiegato ai microfoni di Sky TG24, riferendosi ai prodotti delle big pharma Merck e Pfizer.
Già un paio di settimane fa, il presidente del Consiglio superiore di sanità, Franco Locatelli, aveva del resto dichiarato che “l’Aifa si è già attivata per acquisire una quantità adeguata del farmaco antivirale orale per il Covid-19 molnupiravir, autorizzato in Gran Bretagna”. La valutazione definitiva dell’agenzia del farmaco italiana sui due farmaci è ora attesa per le prossime settimane.
I farmaci orali anti-Covid
L’antivirale Lagevrio, basato sul principio attivo molnupiravir, è stato già approvato e autorizzato, a inizio novembre, dall’ente regolatore del Regno Unito. Anche se, sottolinea Magrini, “anche in Gran Bretagna non è ancora disponibile”. Il farmaco di Merck e Ridgeback Biotherapeutics, che sarebbe in grado di dimezzare il rischio di ospedalizzazione o di morte, è stato nel frattempo presentato anche alla Fda statunitense.

Anche Pfizer, adesso, ha annunciato di aver richiesto all’autorità americana l’autorizzazione all’uso in emergenza del suo farmaco Paxlovid per il trattamento di pazienti a più alto rischio di ricovero o morte malati di Covid-19. Alla domanda di registrazione presentata alla Fda sono stati allegati i risultati dello studio di fase 2-3, dai quali emerge che Paxlovid, somministrato entro tre giorni dall’inizio dei sintomi, riduce la possibilità di ricoveri e decessi dell’89%. E l’abbinamento con una bassa dose del retrovirale ritonavir aumenta i tempi in cui il farmaco resta attivo nell’organismo.
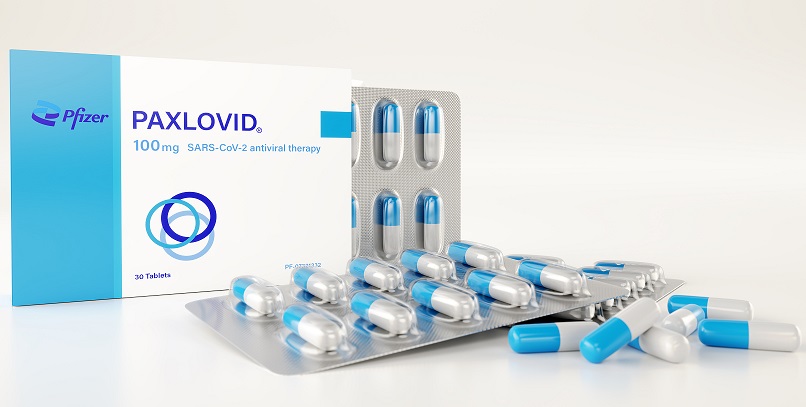
Paxlovid, la pillola di Pfizer
Tecnicamente, il farmaco di Pfizer agisce su un enzima che serve al virus per replicarsi.
Tra i suoi vantaggi, la possibilità di un trattamento domiciliare del Covid con una terapia orale antivirale fin dal manifestarsi dei primi segni di infezione, attraverso l’assunzione di 30 compresse in 5 giorni.
Il farmaco è stato testato, da settembre, su un campione di 1.219 pazienti positivi al Covid provenienti da tutto il mondo, non ospedalizzati ma ritenuti ad alto rischio, confrontando i risultati con un gruppo a cui è stato somministrato un placebo.
A 4 settimane dalla somministrazione, la percentuale di ricovero tra chi ha ricevuto l’antivirale è stata dello 0,8% rispetto al 7% del campione di controllo. Soprattutto, i decessi registrati nello stesso periodo si sono azzerati tra coloro a cui è stato somministrato il Paxlovid rispetto alle 10 morti tra chi ha ricevuto il placebo.
Anche gli effetti collaterali, nella maggioranza dei casi lievi, sono stati lamentati solo dal 19% del campione, contro il 21% del gruppo placebo. Pfizer sottolinea anche che il farmaco si è dimostrato in vitro efficace contro le varianti di Sars-CoV-2 e altri coronavirus noti.
Un impegno solidale per i farmaci anticovid
La big pharma ha previsto un investimento fino a 1 miliardo di dollari per il sostegno alla produzione e alla distribuzione del Paxlovid. Il farmaco è stato presentato, oltre che negli Usa, anche in Gran Bretagna, Australia, Nuova Zelanda e Corea del Sud. E sono già stati stipulati accordi di acquisto anticipato con diversi Stati. Sulla falsariga di quando deciso per Lagevrio da Merck, che ha firmato un accordo con il Medicines Patent Pool per concedere sub-licenze ai produttori di farmaci generici, anche Pfizer ha sottoscritto un contratto di licenza volontaria con l’organizzazione sostenuta dall’Onu.
In base all’accordo, il farmaco potrà quindi essere più facilmente accessibile alle popolazioni di 95 Paesi poveri, raggiungendo così il 53% della popolazione mondiale, anche in questo caso attraverso un farmaco generico basato sullo stesso principio attivo. L’idea di fondo è quella di un approccio tariffario a più livelli, basato sul livello di reddito di ciascun Paese, per promuovere l’equità di accesso in tutto il Mondo.
La previsione di produzione è di circa 200 mila trattamenti entro fine 2021 e 50 milioni di trattamenti nel 2022.
Vaccini: Ema valuta Novavax
L’Agenzia del farmaco europea ha intanto annunciato la chiusura della rolling review partita a febbraio e il conseguente avvio della valutazione della domanda di commercializzazione condizionata per il vaccino anti-Covid realizzato dalla statunitense Novavax. I tempi per la valutazione del Nuvaxovid (questo il nome di quello che sarebbe il quinto siero contro il coronavirus approvato nell’Unione Europea) saranno particolarmente rapidi e il parere dell’Ema potrebbe arrivare entro poche settimane.
Attualmente, è autorizzato per l’uso in emergenza solo in Indonesia, ma ha registrato, nella fase 3 di test, un efficacia al 100% contro le forme di Covid anche gravi e del 93,4% nei confronti delle varianti.
La tecnologia delle proteine ricombinanti
La tecnologia alla base di questo vaccino è quella delle proteine ricombinanti, già utilizzata da una trentina d’anni per i sieri contro epatite B e meningite. Questa tecnica impiega, per stimolare il sistema immunitario, gli antigeni dell’agente patogeno prodotti in laboratorio attraverso l’ingegneria genetica e poi purificati. Già ad agosto, la Commissione europea aveva annunciato la firma del contratto per 200 milioni di dosi di Nuvaxovid. Sulla base dell’accordo, una volta arrivato il via libera di Ema, gli Stati membri dell’Unione potranno comprare fino a 100 milioni di dosi, con opzione di altre 100 fino al 2023.
Alberto Minazzi
Leggi anche: https://www.metropolitano.it/europa-ottobre-2021-vaccino-novavax/
Leggi anche: https://www.metropolitano.it/gran-bretagna-farmaco-orale-anticovid/
Leggi anche: https://www.metropolitano.it/molnupiravir-primo-farmaco-anticovid-in-europa/